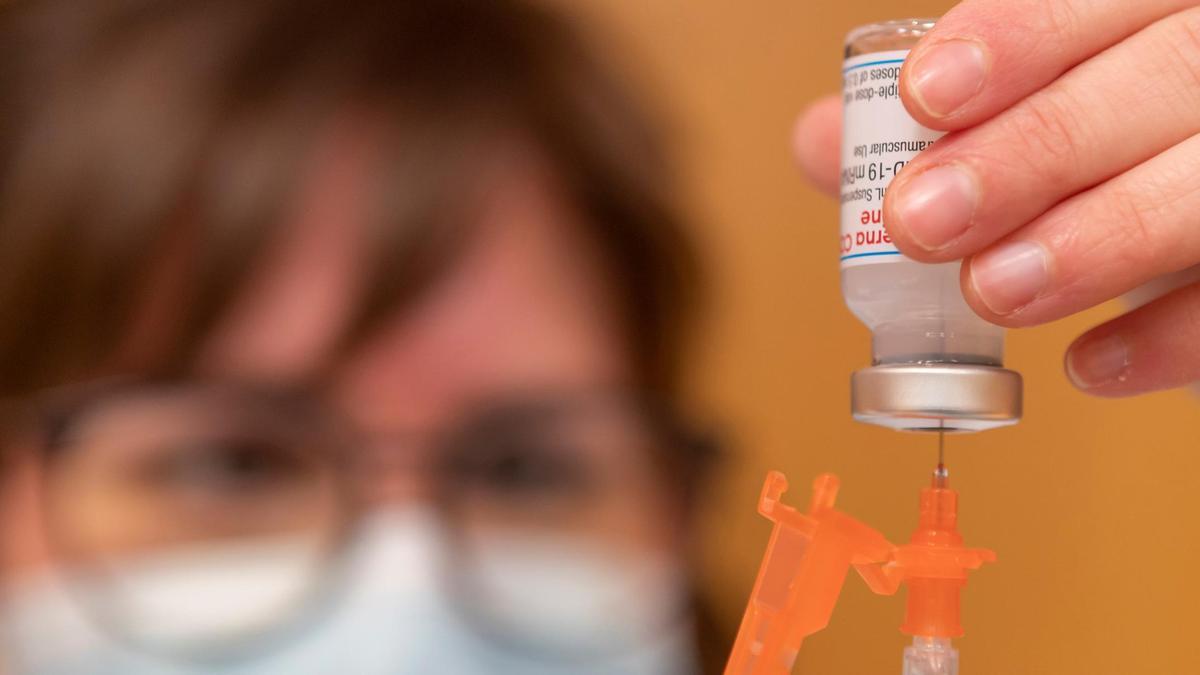
Pese a los ocho casos de trombos inusuales vinculados a la inyección de la vacuna de Janssen, la Agencia Europea del Medicamento (EMA en sus siglas en inglés) considera que los beneficios del suero monodosis desarrollado por la farmacéutica estadounidense, lo mismo que en el caso de la vacuna de AstraZeneca, son mayores que los riesgos provocados por los efectos secundarios del covid-19. Es la principal conclusión de la investigación realizada por la EMA sobre la seguridad del medicamento, cuya administración quedó suspendida hace dos semanas, que avala su utilización.
El comité de evaluación de riesgos de farmacovigilancia de la EMA (PRAC) puso en marcha la investigación hace dos semanas a raíz de la decisión de las autoridades estadounidenses de recomendar la suspensión de la administración de la vacuna y la decisión de Johnson&Johnson de aplazar las entregas, a raíz de seis casos de coagulación sanguínea venosa (CVST) en personas que recibieron la vacuna en Estados Unidos. En este país, al 13 de abril, habían recibido la vacuna de Janssen más de 7 millones de personas.
La conclusión, hecha pública este martes, señala que en adelante será necesario incluir en la información del producto desarrollado por el laboratorio Janssen una advertencia sobre posibles coágulos sanguíneos inusuales con plaquetas bajas en sangre. Según el PRAC estos eventos deberían incluirse como efectos secundarios muy raros sobre los que profesionales sanitarios y pacientes deben ser conscientes. En todo caso, según la EMA, la conclusión es que los beneficios de la vacuna siguen superando a los riesgos entre las personas que la reciben y que es "altamente efectiva" para prevenir la infección provocada por el covid19.
Afectados: menores de 60 años
“La combinación notificada de coágulos sanguíneos y plaquetas bajas en sangre es muy rara, y los beneficios generales de la vacuna de Janssen en la prevención del covid19 superan los riesgos de efectos secundarios”, señala el dictamen. Para llegar a esta conclusión el PRAC ha analizado todas las pruebas disponibles, incluidos los ocho casos de Estados Unidos, uno de los cuales tuvo un desenlace fatal. Hasta el momento no se han identificado casos en la Unión Europea, aunque según ha explicado la directora ejecutiva de la agencia, Emer Cooke, "en la UE se han administrado muy pocas".
En el caso de Estados Unidos, “todos los casos ocurrieron en personas menores de 60 años dentro de las tres semanas posteriores a la vacunación, la mayoría en mujeres” aunque según la información disponible, “no se han confirmado factores de riesgo específicos”, ha explicado la agencia. Los casos raros de trombos, similares a los identificados con la vacuna Axzevria de AstraZeneca que también se basa en adenovirus, se produjeron principalmente en las venas del cerebro (trombosis del seno venoso cerebral, CVST) y el abdomen (trombosis de la vena esplácnica) así como en las arterias, junto con niveles bajos de plaquetas en sangre y a veces, sangrado.
Estudios adicionales
Una posible explicación para esta combinación de coágulos sanguíneos y plaquetas bajas es una "respuesta inmune", que conduce a una condición similar a la que se observa a veces en pacientes tratados con heparina. Por el momento, no se ha identificado un factor de riesgo claro debido a la edad o el género. Cooke ha explicado que las investigaciones seguirán en adelante, que el laboratorio Janssen tendrá que realizar también nuevos estudios y ha anunciado que la EMA ha encargado un estudio sobre casos de trombosis a través de dos consorcios de investigación.
El respaldo de la EMA supone un espaldarazo para administrar la cuarta vacuna autorizada por el regulador europeo -el pasado 11 de marzo- tras la de BioNTech/Pfizer, Moderna y AstraZeneca, y de la que se esperan 55 millones de dosis en este segundo trimestre del año. Los gobiernos habían detenido la administración de este antídoto hasta disponer de la evaluación de la EMA. "La evaluación proporciona a las autoridades sanitarias responsables de las campañas de vacunación información importante para que tomen decisiones basadas en la situación nacional", ha explicado Cooke.
Estrategia de vacunación
Este lunes se ha conocido uno de los borradores en los que trabaja la Comisión de Salud Pública, donde se aborda la conveniencia de aumentar el intervalo entre la primera y la segunda dosis de la vacuna contra el coronavirus para los menores de 79 años, con el fin de acelerar la inoculación de al menos un suero al mayor número de personas vulnerables, en la línea de lo que ha hecho Gran Bretaña.
En concreto, el documento propone continuar con la separación de segundas dosis de Pfizer y Moderna tal como se recoge en la estrategia actual (21 días y 28 días, respectivamente) pero aumentar el intervalo en los menores de 79 años entre seis u ocho semanas.
Por el momento, la Agencia Europea del Medicamento ha avisado de que las vacunas de covid-19 autorizadas "deben usarse tal y como se describe en el prospecto del producto", lo que se traduce en dos dosis con "tres semanas" de diferencia entre la primera y la segunda en el caso de Pfizer/BioNTech y "28 días" para Moderna.
El director del Centro de Coordinación de Alertas y Emergencias Sanitarias, Fernando Simón, ha querido precisar que este es un documento en el que se exponen opiniones, y que no es "bueno que se discuta de borradores porque se mediatiza la discusión de los técnicos".
La Comisión de Salud Pública reúne a técnicos del Ministerio y de las comunidades autónomas, que después elevan sus acuerdos al Consejo Interterritorial donde los consejeros autonómicos y el Gobierno deciden.
El Gobierno y las comunidades autónomas tienen también pendiente decidir si administrar la segunda dosis de AstraZeneca a los menores de 60 años ya vacunados con la primera o apostar por la inoculación de otra vacuna.
Tras decidirse que este vacuna quedaba prescrita para los mayores de 60, unos dos millones de personas menores de esta edad están pendientes aún de saber si van a recibir la segunda dosis de AstraZeneca, bien de otra farmacéutica o ninguna más.
Precisamente, la Agencia Española del Medicamento ha autorizado este lunes el primer ensayo clínico que evalúa la seguridad y el efecto protector de administrar Pfizer a los ya vacunadas con AstraZeneca. Hay 600 voluntarios.
Por otra parte, la Comisión de Salud Pública tiene sobre la mesa otros documentos a debate, entre ellos las recomendaciones ante la reactivación progresiva de eventos y actividades multitudinarias y la prohibición de fumar en las terrazas.
Detienen la producción de vacunas
Por otra parte, las autoridades reguladoras estadounidenses ordenaron la paralización de la producción de la vacuna anticovid de Johnson & Johnson en una fábrica, donde previamente se habrían dañado 15 millones de dosis del medicamento.
El gigante farmacéutico dijo a AFP a fines de marzo que había identificado un lote de dosis en una planta en Baltimore administrada por Emergent BioSolutions "que no cumplía con los estándares de calidad", pero no confirmó la cifra específica afectada.
Según 'The New York Times', el lote consistía de unos 15 millones de dosis.