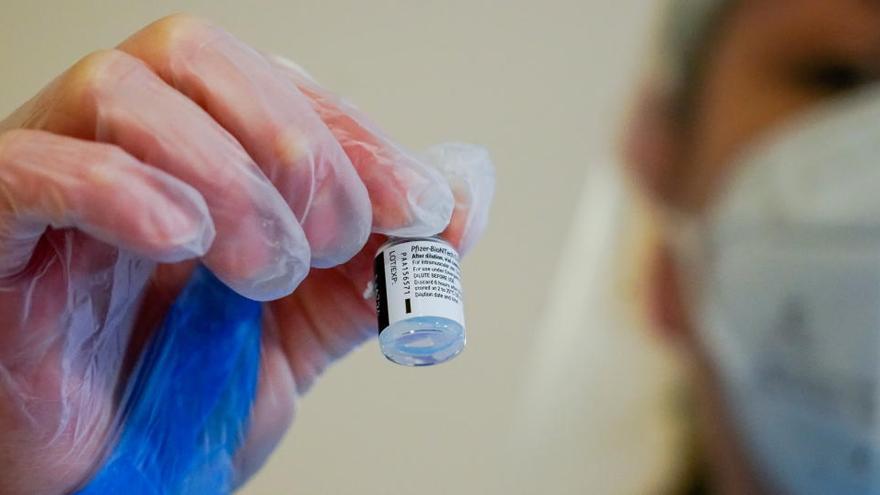
La Agencia Europea del Medicamento (EMA) ha actualizado este viernes la información de la vacuna del covid-19 de Pfizer/BioNTech para "aclarar" que cada vial de este fármaco contiene en realidad suficiente dosis como para extraer seis inyecciones, en lugar de las cinco recomendadas hasta ahora.
Para poder obtener las seis dosis completas, la EMA pide utilizar para la extracción una jeringuilla de "bajo volumen muerto" (de no más de 35 microlitros), y advierte de que "si se utilizan jeringas y agujas estándar, es posible que no haya suficiente vacuna para extraer una sexta dosis de un vial".
De seguir estas recomendaciones, los países de la Unión Europea podrían obtener decenas de miles de inyecciones adicionales a las previstas inicialmente, pero, en caso de no obtener la dosis completa de un vial, los 0,3 mililitros, el sanitario debe desechar el resto del contenido.
"No debe haber una combinación de varios viales para obtener una dosis completa y cualquier vacuna no utilizada debe desecharse seis horas después de la dilución", advierte la EMA, sobre la posibilidad de agrupar el contenido de diferentes viales para alcanzar los 0,3 mililitros que se necesitan para una inyección contra el covid-19.
Por su parte, la Comisión Europa (CE) anunció que ha alcanzado un acuerdo para adquirir hasta 300 millones de dosis adicionales de la vacuna de Pfizer/BioNTech, con lo que duplica el número de dosis ya firmadas para vacunar a los europeos, una compra que se produce tras las crecientes críticas a Bruselas por no haberse abastecido de más vacunas de Pfizer con anterioridad, al ser el primer antídoto del covid-19 aprobado en la Unión Europea (UE).
La vacuna de Pfizer es la única que se está utilizando a día de hoy en la UE, aunque el pasado miércoles, la Comisión, tras una recomendación de la EMA, otorgó una licencia de uso condicional a la vacuna desarrollada por Moderna y se espera que las primeras dosis empiecen a repartirse a los países miembros a partir de la semana que viene.
Este viernes, la EMA explicará en un acto público los detalles de su evaluación de la vacuna de Moderna que, al igual que la de Pfizer, se utilizará en dos dosis con varias semanas de diferencia para poder inmunizar contra el SARS-CoV-2.
La vacuna de Oxford, a final de mes
Por otro lado, la Agencia Europea del Medicamento (EMA) aseguró este viernes que espera concluir su evaluación sobre la vacuna de la farmacéutica AstraZeneca y la Universidad de Oxford "a finales de enero", en base a los datos recibidos esta última semana por parte de los desarrolladores.
La agencia recibió ya el último paquete de información sobre la seguridad, eficacia y calidad de la vacuna de Oxford y espera que la farmacéutica esté lista para presentar una solicitud pidiendo a los científicos de la EMA que estudien recomendar a la Comisión Europea que le otorgue una licencia de uso condicional a su vacuna en la Unión Europea.
"Estamos en diálogo continuo con la empresa y recibimos nueva información todo el tiempo. La empresa aún no ha presentado una solicitud formal de autorización de comercialización para esta vacuna. Comunicaremos cuándo estén listos para enviar una solicitud de autorización", confirmó este viernes a Efe una portavoz de la EMA, Rebecca Harding.
En un evento público en el que la agencia explicó hoy su evaluación de la vacuna de Moderna, aprobada el pasado miércoles, la directora de la EMA, Emer Cooke, calculó que podrían "tomar una decisión antes de finales de enero" sobre una posible Autorización de Comercialización Condicional (CMA, en sus siglas en inglés) en la UE.
Aseguró que la fecha concreta en la que el comité de medicamentos humanos (CHMP) se reunirá para terminar su evaluación de los datos disponibles la confirmará la EMA una vez AstraZeneca envíe su solicitud para una autorización que, de lograrse, estará condicionada a que la farmacéutica continúe sus investigaciones de los ensayos clínicos durante varios años, vigile las campañas de vacunación y comparta informes periódicos con la EMA.
El CHMP ya estudió varios informes sobre seguridad y eficacia del antídoto que resultaron de un análisis de datos clínicos provisionales de varios ensayos que están en marcha en el Reino Unido, Brasil y Sudáfrica, además de datos de estudios de laboratorio y otros sobre la calidad del fármaco, lo que incluye sus ingredientes y su proceso de fabricación.
Hasta ahora, esta agencia, con sede en Ámsterdam, solo ha recomendado una licencia para los antídotos desarrollados por Pfizer/BioNTech el pasado 21 de diciembre, y Moderna el pasado miércoles, aunque de momento sólo la primera se está usando en las campañas de vacunación en los países europeos.
A la espera de la opinión de los científicos europeos, la vacuna de AstraZeneca ya recibió el respaldo de los reguladores británicos y mexicanos.
Los retrasos en su aprobación se debe a los últimos datos científicos compartidos por AstraZeneca, que crearon confusión sobre la dosis correcta que hay que inyectar para que el fármaco sea más eficaz.
Cuando se administra media dosis seguida de una dosis completa, el nivel de eficacia de la vacuna asciende al 90 %, pero desciende al 62 % si se reciben dos dosis enteras del fármaco, que se elaboró a partir de la modificación genética de un virus común de resfriado que afectaba a chimpancés.